Передача нервного импульса
1. Общая
информация о нейронах
2. Потенциал
действия и потенциал-зависимые ионные каналы
2.1.
Натриево-калиевый насос заряжает «батарею», доставляющую энергию для
потенциалов действия
2.2.
Мембранный потенциал зависит от избирательной проницаемости мембраны
2.3. При
деполяризации натриевые каналы сначала открываются, а затем инактивируются
2.5. Каналы с
воротами открываются и закрываются по закону «всё или ничего»
2.6. Энергия
различных конформационных состояний каналов контролируется электрическим полем
мембраны
2.7.
Потенциал-зависимые натриевые каналы ответственны за возникновение потенциала
действия
2.8. Потенциал
действия не зависит от величины возбудившего его сигнала
Рассматриваемый сложный процесс
возбуждения и передачи нервного импульса основан на простых физических
явлениях. Движение ионов объясняется с помощью процесса диффузии, а система
«внешняя среда – клеточная мембрана – цитоплазма» представляет собой плоский
конденсатор, где внешняя среда и цитоплазма играют роль пластин, а мембрана –
диэлектрика.
1. Общая
информация о нейронах
Нервная система человеческого тела состоит из
отдельных клеток – нейронов, которые принимают, проводят и передают
электрические сигналы. Значение этих сигналов зависти от того, какую роль
данная клетка играет в функционировании нервной системы. Основными известными
видами нейронов являются: мотонейроны, сигналы которых служат
командами для сокращения определенных мышц, сенсорные нейроны,
передающие информацию о каком-либо виде раздражителей (свет, механическая сила
или химическое вещество), и интернейроны, сигналы которых
представляют собой результаты совместной переработки сенсорной информации из
нескольких различных источников, приводящей к формированию адекватных
двигательных команд.
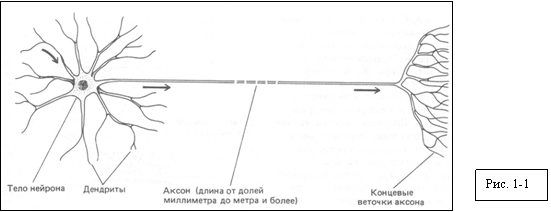
Функция нейрона зависит от его формы - эта форма
определяет, в каких местах возможен прием сигналов и к каким местам эти сигналы
должны быть подведены. У человека длина мотонейрона, посылающего отросток от
спинного мозга к мышце ступни, может достигать целого метра. Обычно можно
выделить три главные части нейрона: тело, дендриты и аксон (рис. 1-1). Тело
клетки - биосинтетический центр, где находятся ядро и почти все рибосомы,
эндоплазматический ретикулум и аппарат Гольджи. Дендриты представляют собой
систему ветвящихся отростков, которые отходят от тела нейрона и увеличивают
поверхность, способную принимать сигналы от других клеток. Аксон тоже отросток
клетки, но обычно он только один и гораздо длиннее дендритов. Аксон проводит
потенциалы действия от тела клетки к удаленной мишени, дальний конец аксона
обычно ветвится, что позволяет передавать сигнал одновременно во много пунктов.
Связь между нейронами обычно
осуществляется с помощью химических сигналов в синапсах, но существуют и другие
виды контактов между клетками. Большая часть поверхности нейрона покрыта
прилегающими к нему глиальными, или шванновскими клетками. Из мембран
шванновских клеток образуется миелиновая оболочка, прерывающаяся через каждые 1
– 2 мм длины аксона перехватами Ранвье, имеющими протяженность около 1 мкм. О
роли их будет сказано позднее.
Несмотря на различные значения сигналов,
природа их во всех случаях одинакова и состоит в изменении электрического
потенциала на плазматической мембране нейрона. Передача сигналов основана на
том, что электрическое возмущение, возникшее в одном участке клетки,
распространяется на другие участки. Если нет дополнительного усиления, эти
возмущения затухают по мере удаления от их источников. На коротких расстояниях
затухание незначительно, и многие нейроны проводят сигналы пассивно, без
усиления. Однако для дальней связи такого пассивного распространения сигнала недостаточно.
Поэтому у нейронов с длинными отростками в ходе эволюции выработался активный
сигнальный механизм, представляющий собой одно из самых удивительных и
характерных свойств нейрона. Электрический стимул, сила которого превышает
определенную пороговую величину, вызывает взрыв электрической активности,
распространяющийся с большой скоростью вдоль плазматической мембраны нейрона.
Эту бегущую волну возбуждения называют потенциалом действия или нервным
импульсом. Потенциал действия передает информацию с одного конца нейрона на
другой без затухания со скоростью до 100 м/с, а в некоторых нейронах еще
быстрее.
2. Потенциал действия и потенциал-зависимые ионные
каналы
Разность потенциалов между внутренней и наружной
сторонами плазматической мембраны - так называемый мембранный потенциал -
зависит от распределения электрического заряда. Заряд переносят через мембрану
нервной клетки небольшие неорганические ионы, главным образом Na+ ,
K+, Сl- и Са2+, причем
проходят они через липидный бислой только по специальным каналам. При
открывании или закрывании ионных каналов распределение зарядов изменяется и происходит
сдвиг мембранного потенциала. Таким образом, передача сигнала нервными клетками
зависит от каналов с регулируемой проницаемостью - так называемых каналов с
«воротами». Наиболее важны два типа каналов:
1) ионные каналы с потенциал-зависимыми воротами,
в особенности Na+ -каналы, которые играют ключевую роль в
возникновении взрыва электрической активности, приводящей к распространению
потенциалов действия по отростку нейрона, и
2) ионные каналы с лиганд-зависимыми воротами,
которые превращают внеклеточные химические сигналы в электрические и играют
центральную роль в функционировании синапсов. Эти два типа каналов свойственны
не только нейронам, они найдены также и в других клетках, например в мышечных
волокнах, где выполняют сходные функции.
2.1. Натриево-калиевый насос заряжает «батарею»,
доставляющую энергию для потенциалов действия
Na+ и К+ - наиболее важные
ионы, участвующие в проведении импульсов в большинстве нейронов. Подобно всем
другим клеткам, нейроны расходуют много метаболической энергии на откачивание
из клетки ионов Na+ в обмен на К+ с помощью Na+
К+ -АТФазы, находящейся в плазматической мембране. В результате
работы этого насоса концентрация Na+ внутри клетки примерно в десять
раз ниже, чем снаружи, тогда как ионов К+ ,наоборот, значительно
меньше снаружи, чем внутри. Эта разность концентраций служит источником
энергии, необходимой для создания тока ионов через плазматическую мембрану.
Запасы этой энергии весьма велики по сравнению с очень малыми энергетическими
затратами на распространение одного потенциала действия и на связанный с этим
кратковременный ионный ток. Даже если Na+ К+ -АТФазу инактивировать каким-нибудь ингибитором,
например уабаином, типичная нервная клетка, действуя как хорошо заряженный
аккумулятор, сможет провести много тысяч потенциалов действия, прежде чем запас
энергии иссякнет. Это связано с тем, что даже очень небольшой поток ионов,
направленный внутрь клетки, переносит достаточный заряд, чтобы вызвать
значительное изменение мембранного потенциала, так как ионы, ответственные за
мембранный потенциал, располагаются в поверхностном слое вблизи мембраны и
удерживаются здесь благодаря электрическому притяжению к ионам противоположного
знака, расположенным по другою сторону. Поэтому можно считать концентрации
ионов Na+ и К+ внутри и снаружи клетки практически
постоянными даже в то время, когда клетка находится в состоянии электрической
активности; ионные токи, связанные с потенциалом действия, настолько малы, что
приводят лишь к ничтожным изменениям ионных концентраций.
2.2. Мембранный потенциал зависит от избирательной
проницаемости мембраны
Зависимость мембранного потенциала от
проницаемости мембраны составляет основу любой электрической активности
нейронов. Представим себе нервную клетку в состоянии покоя, когда
внутриклеточные концентрации Nа+ и К+ определяются
равновесием между ионными токами, создаваемыми работой Na+ К+ -АТФазы, и обратным
переходом Na+ и К+ «вниз» по градиентам их концентраций
через «каналы утечки» (см. разд. 6.4.5). Состояние покоя в физических терминах
определяется следующим образом: стационарное состояние, или потенциал покоя, -
это мембранный потенциал, при ко тором суммарный ток ионов через мембрану равен
нулю. Иными словами, при потенциале покоя токи Na+, К+, Сl- и других ионов, в отдельности не обязательно
равные нулю, точно сбалансированы таким образом, что суммарные заряды по обе
стороны мембраны не изменяются.
Движение любого отдельного вида ионов через
мембранные каналы происходит за счет энергии разности электрохимического потенциала
данного иона. Эту разность образуют две составляющие: разность электрического
потенциала на мембране (электрическое напряжение) и разность концентраций иона
по обе стороны мембраны (энтропия). Когда обе силы точно уравновешивают друг
друга, разность электрохимического потенциала равна нулю, так же как и
суммарный ток данного иона через мембрану Состояние динамического равновесия
количественно описывается простой формулой - уравнением Нернста. Если разность потенциалов между двумя сторонами
мембраны обозначить V, а внутреннюю и наружную концентрации ионов - соответственно
сi и с0, то суммарный ток ионов через мембрану будет
равен нулю при условии, что
![]() ,
,
где R - газовая постоянная, Т - абсолютная
температура, F
-постоянная Фарадея и z - валентность иона.
Для одновалентного иона при комнатной температуре
![]() .
.
Таким образом, суммарный ток ионов Na+
равен нулю, если мембранный потенциал, называемый в данном случае натриевым
равновесным потенциалом, VNa, равен 58*lg([Na+]0/[Na+]i) мВ. Точно так же суммарный ток ионов К+
будет равен нулю при значении мембранного потенициала 58*lg([К+]0/[К+]i) мВ, что соответствует калиевому равновесному
потенциалу, VK. Обычно значения VNa+ лежат в области
между +50 и +65 мВ, VK- между -70 и -100 мВ.
Для любого данного мембранного потенциала
суммарная сила, выталкивающая ионы из клетки, пропорциональна разности V-VNa для Na+ и V-VK для К+. Фактическая величина тока
каждого иона зависит не только от этой движущей силы, но и от того, насколько
легко данный ион проходит через мембранные. Если проводимости групп каналов для Na+
и К+ обозначить соответственно как gNa и gK, токи Na+ и К+ , будут
равны соответственно gNa(V-VNa) и gK(V-VK). (Проводимость - величина, обратная
сопротивлению, - измеряется в единицах, обратных Ому, или Сименсах, См).
По определению при потенциале покоя токи различных
ионов сбалансированы так, что суммарный электрический ток равен нулю. Таким
образом, если V-потенциал покоя, то его величина должна
удовлетворять следующему уравнению:
gNa(V- VNa) + gK(V- VK) + ток, создаваемый Na+ К+ -АТФазой,
+ ток, переносимый другими ионами, = 0.
Так как каналы «утечки» гораздо более проницаемы
для К+, чем для Na+, то gК+ - величина относительно большая, а ток, создаваемый
Na+ К+ -АТФазой, и токи, связанные с передвижением
других ионов, относительно малы. Поэтому ток К+ может быть
уравновешен другими токами, представленными в уравнении, лишь в том случае,
если величина V-VK близка к нулю. Следовательно, потенциал покоя
должен быть близок к равновесному потенциалу для калия VK , величина которого обычно лежит в пределах от -70
до -100 мВ. Если мембранный потенциал будет отличаться от потенциала покоя V, возникнет суммарный поток ионов, который будет стремиться приблизить
мембранный потенциал к уровню V.
По тем же самым причинам при увеличении
проводимости для ионов Na+ (gNa)
мембранный потенциал сместится к новому уровню, близкому к равновесному
потенциалу для натрия. В действительности именно это и происходит на короткий
момент во время прохождения импульса (потенциала действия) в результате
открывания потенциал-зависимых натриевых каналов. В отличие от каналов утечки
эти каналы почти все закрыты, когда нейрон находится в состоянии покоя, и
открываются только при изменении мембранного потенциала. Свойства
потенциал-зависимых натриевых каналов будут подробно рассмотрены ниже.
2.3. При деполяризации натриевые каналы сначала
открываются, а затем инактивируются
По определению потенциал-зависимые каналы - это
такие каналы, которые открываются и закрываются в ответ на изменение
трансмембранного потенциала. Это наводит на мысль о каком-то простом механизме
«включения» и «выключения» каналов. Но в случае натриевых каналов,
ответственных за потенциал действия, этот механизм несколько сложнее, и
существенную роль в нем играет временная задержка. Поведение канала можно
исследовать с помощью метода фиксации напряжения. Если мембранный потенциал
поддерживать на уровне нормального потенциала покоя (примерно -70 мВ),
натриевый ток практически отсутствует; это указывает на то, что почти все
натриевые каналы закрыты. Если теперь резко сдвинуть мембранный потенциал в
положительную сторону, скажем до 0 мВ, и удерживать клетку в таком
деполяризованном состоянии, то потенциал-зависимые натриевые каналы откроются и
ионы Na+ потекут в клетку «вниз» по градиенту концентрации. Этот
натриевый ток достигнет максимума примерно через 0,5 мс после того, как
установится новое значение потенциала. Однако уже спустя несколько миллисекунд
ток падает почти до нуля, даже если мембрана остается деполяризованной (рис. 2.3-1).
Значит, каналы открылись на какой-то момент и вновь закрылись. Закрывшись,
каналы переходят в инактивированное состояние, которое явно отличается от их
первоначального закрытого состояния, когда они еще были способны открыться в
ответ на деполяризацию мембраны. Каналы остаются инактивированными до тех пор,
пока мембранный потенциал не вернется к исходному отрицательному значению и не закончится
восстановительный период длительностью в несколько миллисекунд.
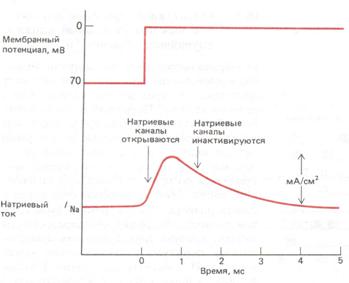 При внезапной деполяризации мембраны от уровня
потенциала покоя до нового постоянного уровня наблюдается кратковременный
натриевый ток, когда потенциал-зависимые натриевые каналы сначала открываются
(быстро), а затем инактивируются (медленно). (Данные для гигантского аксона
кальмара, полученные при 6°C.)
При внезапной деполяризации мембраны от уровня
потенциала покоя до нового постоянного уровня наблюдается кратковременный
натриевый ток, когда потенциал-зависимые натриевые каналы сначала открываются
(быстро), а затем инактивируются (медленно). (Данные для гигантского аксона
кальмара, полученные при 6°C.)
![]()
2.4. Флуктуации трансмембранного тока позволяют
предположить, что каждый отдельный канал открывается и закрывается случайным
образом
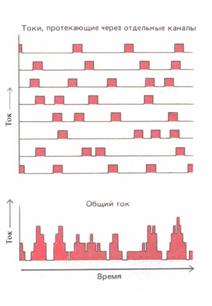
Рис.
2.4-1
Мембрана нервной клетки
содержит много тысяч натриевых каналов с потенциал-зависимыми воротами, и общий
натриевый ток складывается из токов, протекающих через все эти каналы. Как же в
таком случае ведут себя отдельные каналы? Поскольку все они идентичны по
структуре, можно было бы думать, что ток, проходящий через каждый канал,
возрастает и падает одновременно с
увеличением и уменьшением общего тока, т. е. разные каналы одного и того же
типа действуют строго синхронно. Вместо этого отельные каналы после
деполяризации могли бы внезапно открываться и закрываться по принципу «всё или
ничего», но действовать асинхронно, несогласованно. Такие индивидуальные
вариации могли бы усредняться и в целом давать плавную кривую тока. В этом
случае при более детальном исследовании должны обнаружиться непредсказуемые
колебания тока: на идеализированную кривую тока будут накладываться небольшие,
но резкие беспорядочные флуктуации, отражающие открывание и закрывание
отдельных каналов. И действительно, такие флуктуации можно наблюдать. Очевидно,
индивидуальные каналы открываются не плавно и не вполне одновременно. Таким
образом, при невозможности получить прямые данные отдельные каналы можно
изучать путем анализа флуктуации тока - этот метод называют флуктуационным
анализом (см. рис. 2.4-1). На основе предположения, что у каждого канала
имеются только два возможных состояния проводимости - он либо полностью закрыт,
либо полностью открыт - и переход из одного состояния в другое происходит
мгновенно, с помощью флуктуационного анализа для проводимости одного открытого
натриевого канала (в нерве лягушки) была получена величина около 10-11
См. Это означает, что при разности электрохимических потенциалов в 100 мВ через
открытый канал протекает ток силой 10-12 А, что соответствует
прохождению примерно 6000 ионов Na+ в 1 мс. Эти подсчеты и предположения, на которых
они базируются, были подтверждены более прямым методом пэтч-клампа (регистрация
токов в очень малых участках мембраны, см. ниже).
2.5. Каналы с воротами открываются и закрываются
по закону «всё или ничего»
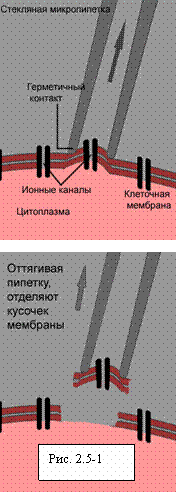 Метод пэтч-клампа дает редкую, почти уникальную
возможность наблюдать кинетику поведения единичной белковой молекулы. Идея сама
по себе проста, но осуществить ее - дело довольно хитрое. Стеклянную
микропипетку, заполненную солевым раствором, прижимают к поверхности клетки и через
верхний конец слегка всасывают воздух, так чтобы мембрана втянулась в кончик
микропипетки (рис. 2.5-1); если стекло чистое и мембрана не покрыта снаружи
внеклеточным материалом, область контакта не будет пропускать тока. Ток может
теперь проходить в пипетку только через белковые каналы в мембране, закрывающей
кончик пипетки. Если плотность расположения каналов невелика, а диаметр носика
пипетки меньше 1 мкм, то в выделенном участке мембраны каналов будет немного - иногда
только один или вообще ни одного. С помощью современной электронной аппаратуры
можно регистрировать и измерять токи силой всего лишь около 10-12 А,
протекающие через единственный канал при изменении разности потенциалов на
данном участке мембраны. На рис. 2.5.-2 представлено несколько типичных записей
тока в одном потенциал - зависимом натриевом канале из мышечной клетки крысы.
Видно, что канал открывается по принципу «всё или ничего». Открытые каналы обладают
одинаковой проводимостью, но открываются и закрываются независимо друг от
друга. Значит, суммарный ток через мембрану всей клетки с ее многочисленными
каналами определяется не степенью открытия каналов, а вероятностью быть
открытым для отдельного канала.
Метод пэтч-клампа дает редкую, почти уникальную
возможность наблюдать кинетику поведения единичной белковой молекулы. Идея сама
по себе проста, но осуществить ее - дело довольно хитрое. Стеклянную
микропипетку, заполненную солевым раствором, прижимают к поверхности клетки и через
верхний конец слегка всасывают воздух, так чтобы мембрана втянулась в кончик
микропипетки (рис. 2.5-1); если стекло чистое и мембрана не покрыта снаружи
внеклеточным материалом, область контакта не будет пропускать тока. Ток может
теперь проходить в пипетку только через белковые каналы в мембране, закрывающей
кончик пипетки. Если плотность расположения каналов невелика, а диаметр носика
пипетки меньше 1 мкм, то в выделенном участке мембраны каналов будет немного - иногда
только один или вообще ни одного. С помощью современной электронной аппаратуры
можно регистрировать и измерять токи силой всего лишь около 10-12 А,
протекающие через единственный канал при изменении разности потенциалов на
данном участке мембраны. На рис. 2.5.-2 представлено несколько типичных записей
тока в одном потенциал - зависимом натриевом канале из мышечной клетки крысы.
Видно, что канал открывается по принципу «всё или ничего». Открытые каналы обладают
одинаковой проводимостью, но открываются и закрываются независимо друг от
друга. Значит, суммарный ток через мембрану всей клетки с ее многочисленными
каналами определяется не степенью открытия каналов, а вероятностью быть
открытым для отдельного канала.
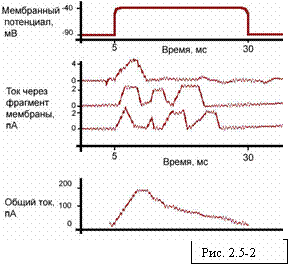
Записи тока через потенциал-зависимые каналы на
участке мембраны, отделенном от клетки. На этом участке, вероятно находятся два
канала. Мембрану резко деполяризовали (верхняя кривая), заставив натриевые
каналы открыться. Три представленные здесь записи тока получены при трех
повторениях опыта на одном и том же участке мембраны. Каждый значительный пик
на кривой тока означает открывание одного канала, за исключением верхней
записи, где, очевидно, два канала открылись одновременно, создав на короткий
период ток удвоенной силы (4 пА вместо 2пА). Небольшие флуктуации тока
обусловлены электрическим шумом в регистрирующей аппаратуре. На нижнем графике
представлена сумма токов, измеренных в 144 повторных опытах. Этот суммарный ток
эквивалентен натриевому току, который проходил бы через относительно большой
участок мембраны, содержащий 228 каналов. Изменение суммарного тока во времени
отражает изменение вероятности того, что какой-либо отдельный канал будет
находиться в открытом состоянии. (По данным R. Horn, J. Patlak, C.F.
Stevens, Nature, 291, 426-427, 1981.)
2.6. Энергия различных конформационных состояний
каналов контролируется электрическим полем мембраны
Свойства потенциал-зависимых натриевых каналов
заслуживают более детального рассмотрения, так как эти свойства типичны и для
других потенциал-зависимых каналов, например калиевых. Во-первых, такие каналы
избирательно проницаемы для определенных ионов. Во-вторых, они не открываются
постепенно, а скачком переходят из одной дискретной конформации в другую. Эти
каналы могут быть или полностью открыты, или полностью закрыты, но никогда не
бывают открыты или закрыты частично. Имеется не менее двух различных «закрытых»
конформации - по меньшей мере одна, в которой канал способен открыться в ответ
на изменение мембранного потенциала, и по меньшей мере одна, в которой канал
инактивирован. Переход от одной конформации к другой представляет собой
вероятностный процесс: имеется определенная вероятность того, что за единицу
времени данная кон-формация при данных условиях сменится другой, подобно тому
как для радиоактивного изотопа существует определенная вероятность распада в
единицу времени. Частота смены конформации характеризуется временем релаксации,
аналогичным периоду полураспада радиоизотопа. Используя такую терминологию,
можно сказать, что натриевый канал в ответ на деполяризацию мембраны сначала
открывается, а затем инактивируется потому, что время релаксации для перехода
от закрытого, но способного к ответу состояния к «открытой» конформации
значительно короче, чем для перехода от любой из этих конформаций к
инактивированному состоянию.
Феномен потенциал-зависимых ворот может быть
объяснен на основе простых физических принципов. Внутренность покоящегося
нейрона на 50-100 мВ более электроотрицательна, чем внеклеточная среда.
Такая разность потенциалов может показаться незначительной, но поскольку
толщина клеточной мембраны всего лишь 5 нм, градиент напряжения здесь достигает
величин порядка 100000 В/см. Таким образом, белки мембраны подвергаются
воздействию очень сильного электрического поля. Мембранные белки, подобно всем
остальным, имеют заряженные группы на своей поверхности и полярные связи
(обусловливающие дипольные моменты) между различными атомами; поэтому
электрическое поле будет стремиться изменить структуру молекулы. С другой
стороны, внутренние силы взаимодействия между различными частями белковой
молекулы относительно велики и стремятся сохранить определенную стабильную
конформацию белка; поэтому на многие мембранные белки изменение электрического
поля мембраны не оказывает, вероятно, существенного влияния.
Однако у потенциал-зависимых каналов в ходе
эволюции выработалась тонкая чувствительность к изменениям электрического поля.
Очевидно, они состоят из белков, которые могут принимать несколько альтернативных
конформаций, каждая из которых стабильна при воздействии малых сил, но может
внезапно смениться другой конформацией, если белок подвергнется достаточно
сильному удару в результате теплового движения окружающих молекул. Для того
чтобы белок (или комплекс белковых субъединиц) прошел через ряд нестабильных
промежуточных конформаций, отделяющих одну квазистабильную конформацию от
другой, требуется энергия. Чем выше этот энергетический барьер, тем реже
осуществляется переход. Каналы очень редко будут принимать квазистабильные
конформаций с высокой энергией, обычно они находятся в низкоэнергетических
состояниях. Если альтернативные конформации различаются распределением заряда,
то при изменении электрического поля будут изменяться относительные энергии таких
конформаций, а вместе с тем и вероятность принятия каналом той или иной
конформации. Поведение потенциал - зависимых натриевых каналов можно легко
интерпретировать на основе изложенных
представлений. Потенциал-зависимый канал может принимать по меньшей мере три
разные квазистабильные конформации. Детальные измерения дают основание
предполагать, что этих конформаций больше.
2.7. Потенциал-зависимые натриевые каналы
ответственны за возникновение потенциала действия
Потенциал-зависимые натриевые каналы делают
нервную клетку чувствительной к действию электрического поля и дают ей
возможность проводить импульсы (потенциалы действия). Для того чтобы объяснить
это, мы сначала познакомимся с последовательностью событий, происходящих при
одновременном возбуждении всех участков клеточной мембраны. Затем мы
рассмотрим, как возбуждение, возникшее на одном конце нервного волокна,
распространяется по всей его длине. Когда клеточная мембрана, содержащая много
натриевых каналов, частично деполяризуется в ответ на кратковременный стимул,
некоторые каналы быстро открываются, пропуская внутрь клетки ионы Na+.
Переход положительных зарядов внутрь ведет к дальнейшей деполяризации мембраны,
и в результате открывается еще больше каналов, пропускающих в клетку ионы Na+.
Этот самоусиливающийся процесс продолжается до тех пор, пока мембранный
потенциал, составлявший вначале —70 мВ (потенциал покоя) не дойдет до +50 мВ
(равновесный потенциал Na+ ). В этот момент, когда суммарная
электрохимическая движущая сила для ионов Na+ равна нулю, клетка
могла бы перейти в новое состояние покоя, при котором все натриевые каналы
постоянно открыты, если бы «открытая» конформация каналов была стабильной. От
такого длительного электрического «спазма» клетку спасает автоматическая
инактивация натриевых каналов, которые постепенно, один за другим, закрываются
и остаются закрытыми, пока мембранный потенциал не вернется к исходной
отрицательной величине, т.е. к уровню покоя. Весь цикл от момента воздействия
стимула до возвращения к состоянию покоя занимает всего лишь несколько
миллисекунд или даже меньше (рис. 2.7-1).
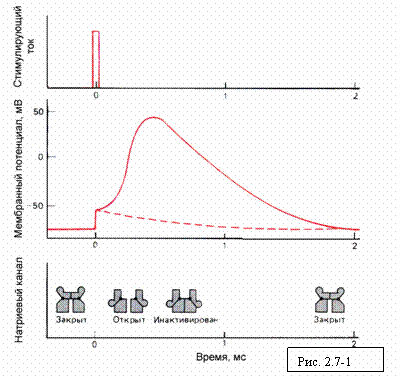 Кратковременный ток, частично деполяризующий
мембрану, вызывает возникновение потенциала действия. На среднем графике
сплошной кривой показаны происходящие при этом изменения потенциала, вызванные
открытием и последующей инактивацией потенциал-зависимых натриевых каналов;
пунктирная кривая показывает, как мембранный потенциал возвращался бы к уровню
покоя после воздействия деполяризующего стимула, если бы в мембране не было
потенциал-зависимых каналов. Заметим, что второй потенциал действия не может
возникнуть до тех пор, пока натриевые каналы не выйдут из состояния
инактивации, которым закончился предыдущий потенциал действия. Пока этого не
произойдет, мембрана устойчива к стимуляции (период рефрактерности).
Кратковременный ток, частично деполяризующий
мембрану, вызывает возникновение потенциала действия. На среднем графике
сплошной кривой показаны происходящие при этом изменения потенциала, вызванные
открытием и последующей инактивацией потенциал-зависимых натриевых каналов;
пунктирная кривая показывает, как мембранный потенциал возвращался бы к уровню
покоя после воздействия деполяризующего стимула, если бы в мембране не было
потенциал-зависимых каналов. Заметим, что второй потенциал действия не может
возникнуть до тех пор, пока натриевые каналы не выйдут из состояния
инактивации, которым закончился предыдущий потенциал действия. Пока этого не
произойдет, мембрана устойчива к стимуляции (период рефрактерности).
Во многих нейронах, хотя и не во всех (важное
исключение составляют миелинизированные аксоны млекопитающих), возвращение к
состоянию покоя ускоряется благодаря потенциал-зависимым калиевым каналам в
плазматической мембране. Эти каналы, подобно натриевым, открываются в ответ на
деполяризацию мембраны, но происходит это относительно медленно. Повышение
проницаемости мембраны для ионов К+ как раз в то время, когда
натриевые каналы инактивируются, позволяет быстро сдвинуть мембранный потенциал
до равновесного потенциала К+ и тем самым вернуть мембрану в
состояние покоя. В результате реполяризации мембраны калиевые каналы вновь
закрываются, а натриевые могут теперь выйти из состояния инактивации. Таким
образом, клеточная мембрана меньше чем за одну миллисекунду вновь приобретает
способность отвечать на деполяризующий стимул.
2.8. Потенциал
действия не зависит от величины возбудившего его сигнала
Только что описанная последовательность событий, когда самоусиливающаяся деполяризация начинается с небольшого изменения мембранного потенциала, характерна для потенциала действия. Чтобы открылось достаточное для запуска этого процесса число натриевых каналов, начальное снижение мембранного потенциала должно деполяризовать мембрану до некоторого порогового уровня. Если этот порог достигнут, дальнейшее усиление деполяризующего стимула уже не будет влиять на максимальную величину сдвига мембранного потенциала: однажды запущенный процесс самопроизвольно идет до конца независимо от силы первоначального стимула. Эту реакцию типа «всё или ничего» можно противопоставить плавному (градуальному) изменению потенциала при открывании лиганд-зависимых каналов в синапсах. Именно благодаря этому принципу «все или ничего» потенциалы действия могут передавать нервные сигналы на дальние расстояния без затухания или искажения.
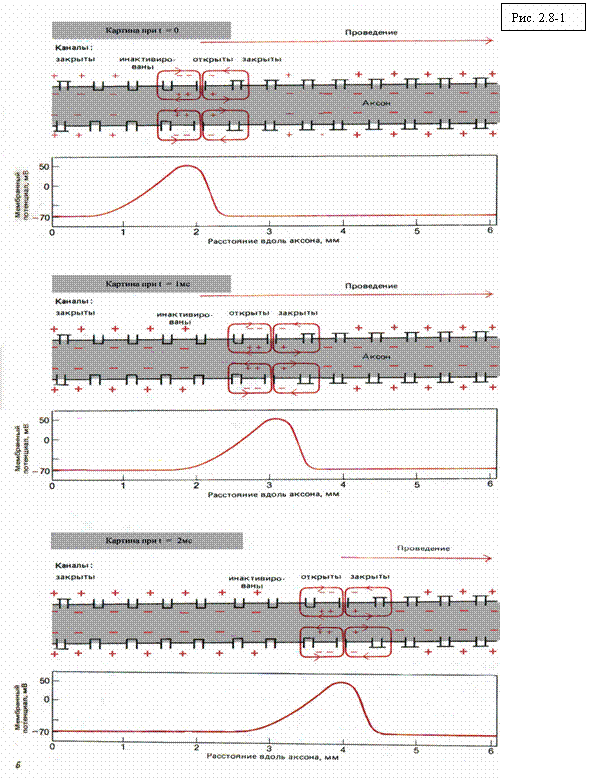
При деполяризации мембраны до порогового уровня
возникают токи, замыкающиеся через наружную проводящую среду. Эти токи
возбуждают следующие участки аксона, в которых деполяризация также достигает порогового
значения (в этом отличие от пассивного распространения),причем суммарный ток
внутри мембраны и во внешней среде равен нулю (см. рис. 2.8-1). Возбужденные
участки, в свою очередь, предают сигнал дальше, и процесс распространяется
вдоль аксона. (Существует внешняя аналогия между распространением нервного
импульса и распространением огня по бикфордову шнуру.) В миелинизированном
волокне распространение импульса происходит быстрее, чем в немиелинизированном.
Калиевые и натриевые каналы открываются только в перехватах Ранвье, так как
миелин является хорошим изолятором, таким образом импульс «перескакивает» с
одного перехвата на другой – такое поведение называется сальтаторным.
Миелинзация аксона позволяет достигать высокий скорости передачи импульса при
очень малом диаметре волокна. Это дало позвоночным важное эволюционное
преимущество, и во многом обусловило их дальнейшее развитие.
Список литературы:
Ходжкин А. Распределение
веществ между клеткой и средой.
Москва, 1965
Ходоров, Б.И. Общая физиология
возбудимых мембран. Москва, 1975
М. В. Волькенштейн Биофизика. Москва: «Наука», 1981
А. Б. Рубин Биофизика.
Москва: «Высшая школа», 1987
B. Alberts, D. Bray, Molecular
Biology of the Cell.
J. Lewis, M. Raff,
K. Roberts, J. D. Watson
(Рус. пер. под ред. Г. П. Георгиева, Молекулярная
биология клетки, Москва: «Мир», 1987)